Термодинамический анализ в системе NI-MO-O-C-H применительно к технологии металлизации металооксидных техногенных отходов прецизионных сплавов типа НМ
А.М. Ковалев, С.М. Григорьев, А.С. Петрищев
Введение
Производство стандартных ферросплавов и легирующих металлических материалов на основе никеля, молибдена и других элементов характеризуется высокой энергоемкостью, многопередельностью и практически достигло предельных значений эффективности по существующим технологиям [1, 2].
В Украине нет собственной материально-сырьевой базы для производства тугоплавких и редких материалов и легирующих материалов на их основе. Вместе с тем, на отечественных производствах выпускается металлопродукция с их использованием, дефицит которых восполняется поставками из-за рубежа.
Определенный резерв в повышении эффективности на переделе выплавки прецизионных сплавов существует при повышении степени использования легирующих элементов из техногенных отходов, таких как никель, молибден и других, который представляет не только научный, но и практических интерес.
Формулировка целей статьи
Целью настоящей работы являлась разработка основных технологических параметров восстановления металлооксидных техногенных никельмолибденсодержащих отходов, а конкретные задачи этого этапа исследований заключались в углубленном изучении термодинамического равновесия соответствующих реакций в системе Ni-Mo-O-C-Н.
Основная часть
Для сравнительной оценки стойкости оксидов молибдена и углерода в интервале температур 300-2000К были использованы данные термодинамических величин (  , S, Cp), которые взяты из справочников [3-7]. Полученные зависимости учитывают влияние температуры на изменение теплоемкости веществ. Также были учтены возможные прохождения полиморфных превращений в исследуемых веществах с изменением термодинамических характеристик реакции.
, S, Cp), которые взяты из справочников [3-7]. Полученные зависимости учитывают влияние температуры на изменение теплоемкости веществ. Также были учтены возможные прохождения полиморфных превращений в исследуемых веществах с изменением термодинамических характеристик реакции.
Во время исследования выявлено, что реакции эндотермические и вероятность восстановления углеродом оксидов молибдена до чистого молибдена существенно увеличивается при температурах выше чем 500К в случае с МоО3, 700К – Мо4О11 и 1000К в случае с МоО2, который с вышеупомянутых оксидов наиболее стабилен, то есть при данных температурах свободная энергия Гиббса приобретает отрицательные значения (рис. 1).

Рисунок 1 – Зависимость свободной энергии Гиббса восстановления оксида MoO2 от температуры
Кривые на рис.1-3 свидетельствуют о большей стойкости МоО2 к восстановлению по сравнению с МоО3 и Мо4О11. Границы исследования кривых приняты в соответствии с температурным интервалом существования того или иного соединения в конденсированных фазах.
Монооксид углерода в исследуемой системе является продуктом реакции твердофазного восстановления оксидов молибдена на начальных стадиях процесса. Не исключается газификация углерода свободным кислородом. Таким образом, появление продукта газификации углерода СО неизбежно приводит к его участию в последующем восстановлении молибдена с его оксидов. Наблюдается вероятность его взаимодействия и восстановления оксидов MoO3 и Мо4О11 до чистого молибдена, на что указывают кривые реакций на рис. 2, 3, которые находятся в отрицательной части графика со значениями изобарно-изотермического потенциала в области -40…-20 кДж, однако кривая восстановления МоО2 монооксидом углерода до Мо (рис. 1) имеет небольшую вероятность, так как линия данной реакции находится в положительной части диаграммы, где энергия Гиббса находится около отметки 10 кДж на всем исследуемом температурном интервале.

Рисунок 2 - Зависимость свободной энергии Гиббса восстановления оксида MoO3 от температуры
Кривые на рис. 2 свидетельствуют о высокой вероятности восстановления триоксида молибдена до диоксида (кривые реакций с образованием СО2 находятся в области графика, ниже -80 кДж), что может обусловливать двустадийность углеродотермического процесса восстановления МоО3 до МоО2, а потом до Мо. Изломы в направлении кривых указывают о точках полиморфных превращений в участвующих в реакциях соединениях.
Наряду с восстановлением высших оксидов молибдена до его низших оксидов и чистого молибдена была исследована вероятность протекания реакций карбидизации. Исходя из рис. 1-3 прослеживается несколько большая вероятность прохождения реакций восстановления оксидов молибдена углеродом до карбидов.

Рисунок 3 - Зависимость свободной энергии Гиббса восстановления оксида Mo4O11 от температуры
В случае МоО3 и Мо4О11 энергия Гиббса принимает отрицательные значения при температурах 500К и 400К соответственно с образованием СО2, в случае с МоО2 данное значение близко к 1000К. Аналогичная тенденция повышения стойкости оксидов молибдена отмечена при применении в качестве восстановителя монооксида углерода, причем в случае с МоО2 восстановление термодинамически вероятно до 1000К.
На рис. 1-3, с целью установления возможного механизма восстановления оксидов молибдена до молибдена металлического, рассмотрена реакция их взаимодействия с карбидами. Установлено, что вероятность восстановления карбидами меньшая, чем углеродом. Если сравнить положение соответствующих кривых на рис. 1-3 оказывается, что восстановление МоO3 и Мо4О11 до Мо при помощи Мо2С получает высокую вероятность при температурах выше 900К, МоО2 – 1200К, то есть при данных температурах изобарно-изотермический потенциал принимает отрицательные значения.
На основе вышеизложенного можно констатировать, что при восстановлении оксидов Мо с повышением температуры существует большая вероятность восстановления высшего оксида молибдена МоО3 монооксидом углерода или карбидами молибдена, которые, могут присутствовать в данной системе, до низшего оксида МоО2. Восстановление МоО2 связано с необходимостью дальнейшего повышения температуры. Подтверждается конкурентоспособность их участия наряду с реакциями восстановления свободным углеродом. Поскольку имеют место реакции с образованием СО, а восстановление молибдена из оксидов его карбидами осложнено, то повышение давления и температуры в зоне реакции способствует смещению равновесия в сторону выхода карбидов молибдена и молибдена свободного.
Наличие в системе двух газообразных компонентов реакции позволяет построить диаграмму равновесия и с достаточной достоверностью предусмотреть области существования фаз в зависимости от двух взаимосвязанных факторов: температуры и концентрации СО. Соотношение СО и СО2 в зависимости от температуры дает дополнительные данные о прохождении равновесных кривых реакций в рассматриваемой системе.
В системе Ni-O-C, аналогично вероятность восстановления оксида никеля NiO до Ni или Ni3C очень близка по значению (рис. 4).

Рисунок 4 – Влияние температуры на изменение свободной энергии Гиббса
Восстановление NiО углеродом до Ni3C становится термодинамически возможным уже при 300К. При данной температуре значение 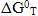 равно -10кДж, в то время как реакция восстановления оксида никеля до никеля металлического значение
равно -10кДж, в то время как реакция восстановления оксида никеля до никеля металлического значение 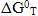 принимает лишь при температуре 500К.
принимает лишь при температуре 500К.
Восстановление NiО с помощью СО до Ni в исследуемом интервале температур имеет приблизительно одинаковые значения 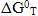 , что равняется -48кДж (рис. 5), в то время как реакция восстановления до Ni3C – эндотермическая, что приводит к изменению энергии Гиббса данной реакции в иследуемом интервале температур с отметки -70кДж до 40кДж. При температуре 700К вероятность восстановления NiО монооксидом углерода до Ni и Ni3C становится того же значения.
, что равняется -48кДж (рис. 5), в то время как реакция восстановления до Ni3C – эндотермическая, что приводит к изменению энергии Гиббса данной реакции в иследуемом интервале температур с отметки -70кДж до 40кДж. При температуре 700К вероятность восстановления NiО монооксидом углерода до Ni и Ni3C становится того же значения.
Исходя из вышеизложенного можно отметить, что в случае протекания углеродотермического восстановления оксида никеля до никеля металлического, существует высокая вероятность возникновения процессов карбидообразования.
Из рис. 5 следует, что существует высокая вероятность восстановления оксида никеля NiO водородом.

Рисунок 5 - Зависимость свободной энергии Гиббса от температуры водородного восстановления оксидов молибдена и никеля
В температурном интервале 300-2000К свободная энергия Гиббса данной реакции принимает значение от -20 до -70 кДж. По степени вероятности восстановления водородом следуют оксиды MoO3 и Mo4O11.
Реакция восстновления MoO3 в температурном интервале 300-1400К имеет значения 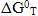 от -15 до -30кДж, а реакция восстновления Mo4O11 в температурном интервале 300-1800К - от -5 до -80 кДж.
от -15 до -30кДж, а реакция восстновления Mo4O11 в температурном интервале 300-1800К - от -5 до -80 кДж.
Меньшая вероятность восстановления водородом из рассмотренных в системе оксидов пренадлежит MoO2. Кривая реакций его восстановления принимает значения свободной энергии Гиббса в исследуемом температурном интервале от 35 до -18 кДж. Из рис. 5 следует, что для достижения необходимого термодинамического равновесия восстановления MoO2 до Мо необходимо повысить температуру процесса до температуры примерно 1500К.
Изломы на кривых это влияние перехода воды, как продукта реакции, из жидкого в газообразное состояние, которое ведет к изменению термодинамических величин.
Анализ диаграммы на рис. 5 позволяет отметить, что восстановление оксидов никеля и молибдена с помощью водорода термодинамически возможно с высокой вероятностью.
К числу недостатков действующей технологии выплавки прецизион-ного сплава 79НМ для холоднокатаных лент с высокими магнитными свойствами следует отнести:
- из-за высокой температуры плавления металлического молибдена существенно увеличивается время его полного растворения в расплаве металла;
- высокий угар молибдена связан с длительным его растворением в расплаве металла и высокой скоростью сублимации высших оксидных соединений молибдена;
- высокая себестоимость выплавки сплава 79НМ из-за использования дорогостоящих металлических легирующих материалов и отсутствия в составе шихты отходов и вторичного сырья.
В основу усовершенствования технологии выплавки лигатуры для легирования и раскисления никельмолибденсодержащих прецизионных сплавов путем дополнительного введения в состав шихты окалины сплава 79НМ, циклонной пыли кремния и технической закиси никеля, а легирующего материала на основе молибдена металлизованного молибденового концентрата. Это дало возможность утилизации легирующих элементов из окалины и отходов абразивной зачистки сплава 79НМ, привело к снижению угара молибдена, сокращению времени его растворения в расплаве металла и снижению себестоимости выплавки сплава 79НМ [1,2].
Выводы
В системе Ni-Mo-O-C-H наблюдаются реакции образования низщего оксида и карбида молибдена. Оксиды молибдена восстанавливаются до молибдена свободного как углеродом, так и продуктами его взаимодействия монооксидом углерода и карбидом молибдена.
Наряду с реакциями восстановления наблюдается процесс карбидообразования. Выход карбида молибдена Мо2С зависит от парциального давления СО и температуры процесса.
Аналогичная направленность и стадийность наблюдается в случае углеродотермического восстановления оксидов никеля.
С учетом полученных результатов термодинамического анализа процессов восстановления оксидов молибдена и никеля углеродом и водородом разработаны составы шихты для получения лигатуры с использованием металлизованных молибдена, окалины сплава 79НМ и других ингредиентов, позволило снизить угар молибдена, сократить время его растворения при легировании расплава металла и снизить себестоимость передела выплавки сплава 79НМ.
Список литературы
- Гасик М.И. Теория и технология производства ферросплавов / Гасик М.И., Лякишев Н.П., Емлин Б.И. - М.: Металлургия. - 1988. - 784с.
- Пат. 18365 Украины, МКИ С22С 35/00. Лигатура для выплавки сплавов на никелевой основе: Пат. 18365 Украины, МКИ С22С 35/00 / С.М. Григорьев, Е.Н. Архипенкова (Украина). №5002496/SU; Заявл. 24.09.93; Опубл. 25.12.97; Бюл. №6.- С. 11.
- Киреев В.А. Методы практических расчетов в термодинамике химических реакций. – М.: Химия, 1970. – С.328.
- Самсонов Г.В. Тугоплавкие соединения (справочник). – [2-е изд.]. – М.: Металлургия, 1976. – С.176.
- А.Н. Крестовников, Л.П. Владимиров, Б.С. Гуляницкий, А.Я. Фишер. Справочник по расчетам равновесий металлургических систем . – М.: Государственное научно-техническое издание литературы по черной и цветной металлургии, 1963. - С. 356.
- Куликов. И.С. Термодинамика оксидов: справ. изд. – М.: Металлургия, 1986. – С.137.
- Карапетьянц М.Х., Карапетьянц М.Л. Основные термодинамические константы неорганических и органических веществ. - М.: Химия, 1968. - 470с.
Рецензент д.т.н., проф. А.Н. Смирнов
© А.М. Ковалев, С.М. Григорьев, А.С. Петрищев
