Аналіз термодинамічної рівноваги в системі NI-CO-O-C-H стосовно технології металізації металооксидних техногенних відходів прецизійних сплавів типу НК
А.М. Ковальов, С.М. Григор’єв, А.С. Петрищев
В статті підтверджено велику вірогідність паралельного протікання карбідоутворення та процесу відновлення шляхом аналізу термодинамічної рівноваги. Доведено, що для металізації окалини прецизійного сплаву доречно використовувати водень замість вуглецю в якості відновника. Промисловими випробуваннями підтверджено технологічну можливість водневого відновлення окалини та економічну доцільність утилізації нікелю та кобальту у власному виробництві прецизійних сплавів.
Вступ
Виробництво металопродукції на основі прецизійних сплавів типу НК у вигляді холоднокатаних стрічок, використання яких забезпечує відсутність гама-альфа перетворень при експлуатації в режимах низьких температур (до -70°С), пов’язано з низкою недоліків, до яких відносяться: до складу шихти на переділі виплавки додається значна кількість металевих легованих матеріалів та лігатур с РЗМ, що здорожує цільовий продукт; низька ступінь утилізації легуючих елементів із техногенних відходів виключає можливість повернення цих елементів з окалини; шліфувального пилу, стружки та ін.; великих час плавки.
Ціль статті
Метою роботи була розробка технології металізації окалини та інших метало-окисних відходів з використанням утилізації нікелю та кобальту у власному виробництві, а задачі по суті цих досліджень полягали в аналізі термодинамічної рівноваги окислювально-відновлювальних процесів з використанням вуглецю та водню.
Основна частина
Для порівняльної оцінки стійкості оксидів кобальту в системі Со-O-C в інтервалі температур 300-2000К були використані данні термодинамічних величин (![]() , S, Cp) що взяті з довідників [1-5]. Одержані залежності враховують вплив температури на зміну теплоємності речовин. Також було враховано проходження поліморфних перетворень в досліджуваних речовинах зі зміною термодинамічних характеристик реакції.
, S, Cp) що взяті з довідників [1-5]. Одержані залежності враховують вплив температури на зміну теплоємності речовин. Також було враховано проходження поліморфних перетворень в досліджуваних речовинах зі зміною термодинамічних характеристик реакції.
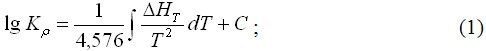
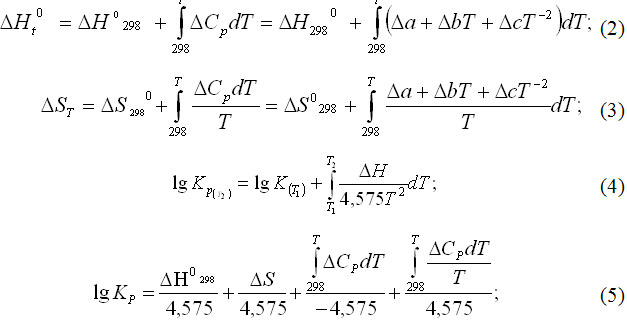

Під час дослідження виявлено, що реакції взаємодії з вуглецем ендотермічні, та імовірність відновлення оксидів кобальту до чистого кобальту суттєво збільшується вже при температурах більших за 300К (рис. 1,2). Більшу схильність до відновлення вуглецем має оксид кобальту Со3О4, причому суттєва імовірність його відновлення до чистого кобальту спостерігається вже при температурах 300-400К. Більш стійкий до відновлення вуглецем виступає нижчий оксид кобальту – CoO. Його відновлення до чистого кобальту стає термодинамічно імовірним при температурах 500-800К. Монооксид вуглецю в досліджуваній системі є продуктом реакції твердофазного відновлення оксидів кобальту на початкових стадіях процесу.
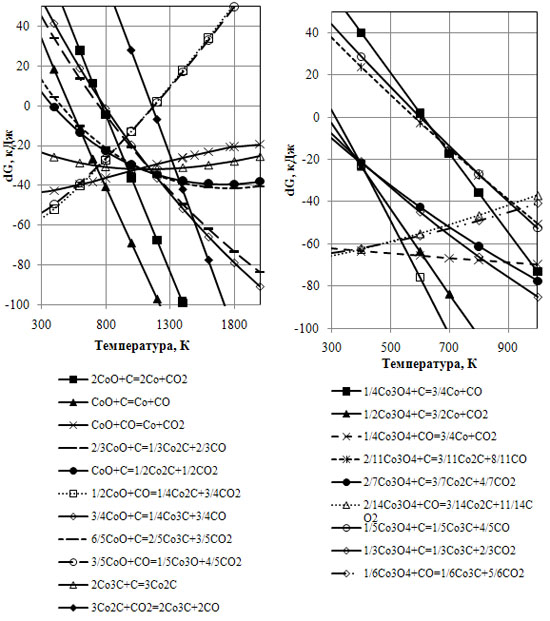
Рисунки 1, 2 – Залежність вільної енергії Гіббса від температури окислювально-відновлювальних реакцій кобальту
Утворення СО в даній системі з підвищенням температури є термодинамічно вигіднішим, ніж СО2. Не виключається газифікація вуглецю вільним киснем.
Таким чином, поява продукту газифікації вуглецю СО неминуче призводить до його участі в послідуючому відновленні кобальту з його оксидів.
Імовірність його взаємодії та відновлення оксидів до чистого кобальту суттєва, на що вказують криві реакцій на рисунку 1 та 2, які знаходяться у від’ємній частині графіку. Для Co3O4 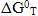 в досліджуваному інтервалі знижується від -60 до -70кДж, а для СоО – підвищується від -45 до -20 кДж.
в досліджуваному інтервалі знижується від -60 до -70кДж, а для СоО – підвищується від -45 до -20 кДж.
На рис. 1,2 зазначені криві реакцій з утворенням карбідів кобальту. Данні реакції ендотермічні. 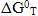 з підвищенням температури для Со2С та Со3С має дуже близькі значення. З рис. 1 випливає, що більша термодинамічна імовірність відновлення Co3O4 та СоО до карбідів кобальту з утворенням СО2 ніж СО, причому відновлення Co3O4 набуває імовірності при температурі більше за 300К (з утворенням СО2) та більше за 600К (з утворенням СО). Для СоО дані температури дорівнюють відповідно 450К та 750К, і при температурі більшій за 1150К домінуюче значення проходження приймають реакції з утворенням монооксиду вуглецю, який в подальшому може слугувати як відновник.
з підвищенням температури для Со2С та Со3С має дуже близькі значення. З рис. 1 випливає, що більша термодинамічна імовірність відновлення Co3O4 та СоО до карбідів кобальту з утворенням СО2 ніж СО, причому відновлення Co3O4 набуває імовірності при температурі більше за 300К (з утворенням СО2) та більше за 600К (з утворенням СО). Для СоО дані температури дорівнюють відповідно 450К та 750К, і при температурі більшій за 1150К домінуюче значення проходження приймають реакції з утворенням монооксиду вуглецю, який в подальшому може слугувати як відновник.
Реакцій відновлення Со3О4 до СоО вуглецем (рис. 3) монооксидом вуглецю та карбідом кобальту мають значення енергії Гіббса в досліджуваному інтервалі менші за -100кДж, що говорить про високу імовірність першочергового проходження даних реакцій.
З рис.4 випливає, що з підвищенням температури стає термодинамічно імовірним відновлення оксидів кобальту його карбідами до кобальту металічного. Відновлення Со3О4 за допомогою Co2C та Co3C з утворенням Со та СО2 стає термодинамічно імовірним вже при температурах 350-400К, відповідно СоО з утворенням Со та СО2 – 580-620К. Утворення в продуктах реакції СО є менш термодинамічно імовірним. Криві реакцій відновлення оксидів кобальту карбідами кобальту перитинають нульову позначку 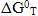 в інтервалі від 350 до 800К.
в інтервалі від 350 до 800К.
Криві реакцій окислення вуглецю до моно- та діоксиду вуглецю, відновлення діоксиду вуглецю до монооксиду (рис.3) свідчать, що при збільшенні температури процесу підвищується імовірність утворення СО при окисленні вуглецю киснем наряду з утворенням СО2, і при температурі 1000К приймає домінуюче значення. Також підвищується імовірність відновлення СО2 до СО. Вищезазначене є важливим, так як підтверджує збільшення відновної здатності середовища з підвищенням температури.
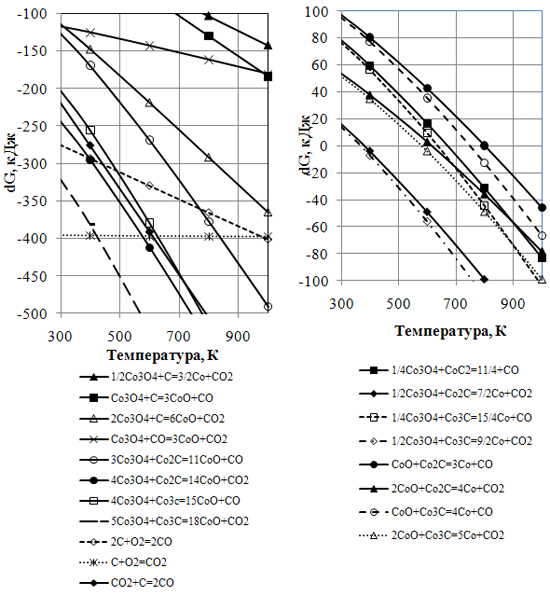
Рисунки 3, 4 – Вплив температури на змінення вільної енергії Гіббса від окислювально-відновлювальних реакцій кобальту
Необхідно також звернути увагу на криві реакцій підвищення та зниження вмісту атомів вуглецю в карбідах кобальту (рис.1), з яких випливає, що взаємодія карбіду кобальту Со3С з вуглецем з утворенням Со2С має високу імовірність при значенні енергії Гіббса -20-30кДж. Крива реакції взаємодії Со2С з СО2 та утворенням Со3С набуває вагомої імовірності при температурах більше за 1150К.
Вцілому, описані діаграми вказують, що з реакцій відновлення оксидів кобальту за допомогою С, СО, Со2С, Со3С до Со2С, Со3С або до Со, що найбільшу імовірність проходження в досліджуваному інтервалі температур мають реакції відновлення Со3О4 по відношенню до СоО.
При цьому, криві реакцій відновлення до Со та карбідів кобальта мать дуже близькі значення 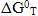 , що свідчить про наявність в продуктах відновлення як чистого кобальту так і його карбідів. Імовірність відновлення оксидів кобальту до кобальту металевого вуглецем дуже близька до імовірності відновлення карбідами кобальту.
, що свідчить про наявність в продуктах відновлення як чистого кобальту так і його карбідів. Імовірність відновлення оксидів кобальту до кобальту металевого вуглецем дуже близька до імовірності відновлення карбідами кобальту.
Що стосується нікелю, то в системі Ni-O-C, аналогічно з випадком Co, імовірність відновлення оксиду нікелю NiO до Ni або Ni3C дуже близька за значенням (рис. 5).
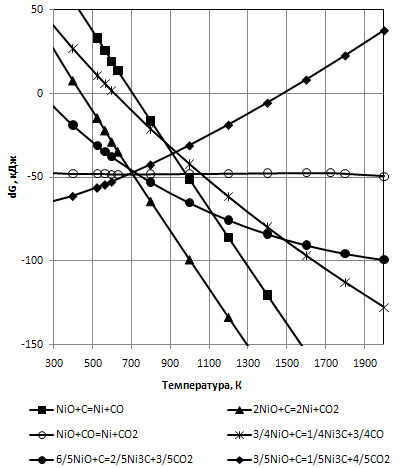
Рисунок 5 – Вплив температури на змінення вільної енергії Гіббса від окислювально-відновлювальних реакцій нікелю
Відновлення NiO вуглецем до Ni3C стає термодинамічно імовірним вже при 300К. При даній температурі значення 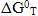 має значення -10 кДж, в той час як реакція відновлення оксиду нікелю до нікелю металевого аналогічне значення
має значення -10 кДж, в той час як реакція відновлення оксиду нікелю до нікелю металевого аналогічне значення 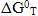 приймає лише при температурі 500К. Відновлення NiO за допомогою СО до Ni в досліджуваному інтервалі температур має приблизно однакове значення
приймає лише при температурі 500К. Відновлення NiO за допомогою СО до Ni в досліджуваному інтервалі температур має приблизно однакове значення 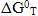 , що дорівнює -48кДж (рис. 5), в той час як реакція відновлення до Ni3C – ендотермічна, що призводе до зміни енергії Гіббса даної реакції в досліджуваному інтервалі температур з позначки -70кДж до 40кДж. При температурі 700К імовірність відновлення NiO монооксидом вуглецю до Ni та Ni3C вирівнюється.
, що дорівнює -48кДж (рис. 5), в той час як реакція відновлення до Ni3C – ендотермічна, що призводе до зміни енергії Гіббса даної реакції в досліджуваному інтервалі температур з позначки -70кДж до 40кДж. При температурі 700К імовірність відновлення NiO монооксидом вуглецю до Ni та Ni3C вирівнюється.
Виходячи з вищевикладеного можна зазначити, що під час прохо-дження вуглецевотермічного відновлення оксиду нікелю до нікелю мета-левого неминуче будуть виникати процеси карбоутворення.
В ході вирішення задач, поставлених в роботі одержані наступні результати:
- проведені відповідні розрахунки рівноваги в системах Со-O-C та Ni-O-C та виконаний аналіз термодинамічних закономірностей вуглецевотермічного відновлення, і свідчать про велику імовірність паралельного протікання реакцій карбідоутворення, так як значення зміни енергії Гіббса близькі за абсолютною величиною в області досліджуваних температур до значень зміни енергії Гіббса для відповідних реакцій;
- така ж тенденція зберігається і при відновленні кобальту та ныкелю з оксидів монооксидом вуглецю, виходячи з цього вірогідність одержання безвуглецевого продукту в цих системах мізерно мала.
З рис. 6 випливає, що найбільш схильний до відновлення воднем оксид кобальту Co3O4. В температурному інтервалі 300-1000К вільна енергія Гіббса даної реакції приймає значення від -35 до -65кДж. Наступний по рівню імовірності відновлення воднем слідує оксид NiO. В температурному інтервалі 300-2000К вільна енергія Гіббса даної реакції приймає значення від -20 до -70кДж. CoO найменш схильний до відновлення воднем серед розглянутих оксидів, але значення 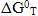 на всьому досліджуваному інтервалі даної реакції мають від’ємне значення в межах від -15 до -45кДж. Злами на кривих – це вплив переходу води, як продукту реакції, з рідкого в газоподібний стан, що веде зміну термодинамічних величин. Аналіз діаграми на рис. 6 дозволяє зазначити, що відновлення оксидів нікелю та кобальту за допомогою водню термодинамічно можливе з високою імовірністю.
на всьому досліджуваному інтервалі даної реакції мають від’ємне значення в межах від -15 до -45кДж. Злами на кривих – це вплив переходу води, як продукту реакції, з рідкого в газоподібний стан, що веде зміну термодинамічних величин. Аналіз діаграми на рис. 6 дозволяє зазначити, що відновлення оксидів нікелю та кобальту за допомогою водню термодинамічно можливе з високою імовірністю.
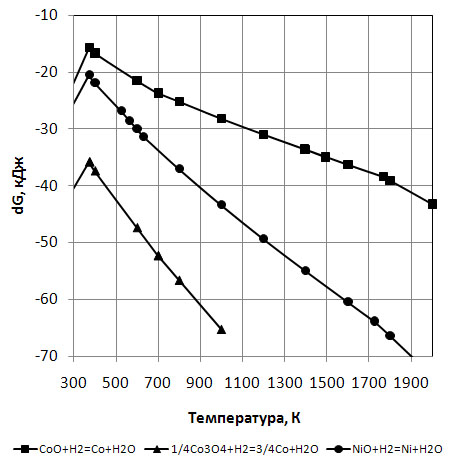
Рисунок 6 - Залежність вільної енергії Гіббса від температури окислювально-відновлювальних реакцій кобальту та нікелю
В промислових випробуваннях задача полягала у підвищенні ступеню утилізації нікелю та кобальту з окисних та засмічених шкідливими домішками дрібнодисперсних відходів. До складу шихти [6] для отримання лігатури додатково додавали окалину сплаву 29НК та пил силового оброблення поверхні металу. Розроблено склад лігатури для легування та розкислення нікель-кобальт-містких сплавів [7], використання якого підвищило ступінь утилізації легуючих елементів з відходів, скорочення часу виплавки сплаву та зменшення собівартості цільової продукції.
Висновки
Виконано аналіз термодинамічної рівноваги в системах Ni-O-C, Co-O-C, Ni-O-H та Co-O-H, чим було підтверджено велику вірогідність паралельного протікання карбідоутворення та процесу відновлення, спираючись на те, що абсолютні значення вільної енергії Гіббса є близькими. Тому отримати безвуглецевий продукт в цих системах використовуючи вуглець в якості відновника майже неможливо, тому це обмежує використання вуглецю в якості легуючої добавки при виплавці прецизійних сплавів. В такому випадку для металізації окалини прецизійного сплаву доречно використовувати водень в якості відновника. Промислові випробування підтвердили технологічну можливість водневого відновлення окалини та економічну доцільність утилізації нікелю та кобальту у власному виробництві прецизійних сплавів.
Список літератури
- Киреев В.А. Методы практических расчетов в термодинамике химических реакций / В.А. Киреев. – М.: Химия, 1970. – С.328.
- Самсонов Г.В. Тугоплавкие соединения (справочник)/ Г.В.Самсонов, И.М. Виницкий. – [2-е изд.]. – М.: Металлургия, 1976. – С.176.
- Крестовников А.Н. Справочник по расчетам равновесий металлургических систем / А.Н. Крестовников, Л.П. Владимиров, Б.С. Гуляницкий, А.Я. Фишер. – М.: Госу-дарственное научно-техническое издание литературы по черной и цветной метал-лургии, 1963. - С. 356.
- Куликов. И.С. Термодинамика оксидов: справ. изд./ Куликов И.С. – М.: Металлур-гия, 1986. – С.137.
- Карапетьянц М.Х. Основные термодинамические константы неорганических и ор-ганических веществ/ М.Х. Карапетьянц, М.Л.Карапетьянц - М.: Химия, 1968. - 470с.
- Пат. 19113 Украины, МКИ С22С 35/00. Шихта для получения лигату¬ры для легиро-вания и раскисления никелькобальтсодержащих сплавов: Пат. 19113 Украины, МКИ С22С 35/00 / С.М. Григорьев, А.С Яценко, Е.Н. Архипенкова (Украина). №5002829/SU; Заявл. 22.09.93; Опубл. 25.12.97; Бюл. №6.- С. 12.
- Пат. 18366 Украины, МКИ С22С 35/00. Лигатура для выплавки никелькобальтсо-держащих сплавов: Пат. 18366 Украины, МКИ С22С 35/00 / С.М. Григорьев, Е.Н. Архипенкова (Украина). №5003028/SU; Заявл. 24.09.93; Опубл. 25.12.97; Бюл. №6.- С. 12.
Рецензент д.т.н., проф. А.Н. Смирнов
© А.М. Ковальов, С.М. Григор’єв, А.С. Петрищев
