Особенности механизма реакций десульфурации металла магнием
Результаты теоретического анализа показывают, что при высокой активности растворенного в металле кислорода образование сульфидов магния возможно только при условии протекания реакций раскисления и десульфурации в диффузионной области у поверхности всплывающих в расплаве пузырей пара реагента.
В настоящее время для описания массообменных процессов у границы раздела фаз разработаны разнообразные модели и концепции массоотдачи примесей из объема жидкого металла к его поверхности. Наиболее простой и распространенной является модель диффузионного пограничного слоя. Она основана на допущении о существовании в пределах каждой из фаз двух областей: ядра (основного объема) и пограничного слоя, прилегающего к поверхности раздела фаз.
Перенос компонентов в основном объеме жидкости, где имеет место интенсивное ее перемешивание, осуществляется преимущественно за счет турбулентной диффузии. Интенсивное перемешивание ядра потока приводит к отсутствию градиентов концентрации переносимого вещества в его пределах.
В пограничном слое перенос вещества осуществляется конвективной и молекулярной диффузией. Причем по мере приближения к межфазной поверхности конвективные потоки затухают, а роль молекулярной диффузии увеличивается. В непосредственной близости от поверхности раздела фаз молекулярный механизм диффузии начинает преобладать над турбулентным. Этот тонкий слой получил название диффузионного пограничного слоя. Перенос вещества в пределах этого слоя контролирует общую скорость массоотдачи компонентов из объема металла к межфазной поверхности.
Допущения, положенные в основу концепции диффузионного пограничного слоя, неоднократно подвергались критике. Несмотря на это, модель диффузионного пограничного слоя до настоящего времени широко применяется для количественного описания процессов массоотдачи вещества из объема расплава к межфазной поверхности в силу ее простоты и удовлетворительного совпадения результатов расчетов и эксперимента.
Наиболее важным из всего сказанного является вывод о том, что в непосредственной близости от границы раздела фаз скорость массоотдачи вещества мала и сравнима со скоростью молекулярной диффузии. Учитывая высокие скорости химического взаимодействия веществ при температурах металлургических процессов, можно ожидать, что лимитирующим звеном реакций, протекающих у поверхности всплывающих пузырей пара магния, будет массоотдача примесей из объема расплава к межфазной поверхности.
Если скорость реакции между магнием и растворенным в металле кислородом ограничена массоотдачей кислорода из объема расплава, активность его у поверхности раздела фаз должна приближаться к равновесной с паром реагента. Так, например, из рисунка 3.2 видно, что при температуре 1400оС в момент выхода пузыря пара магния из объема металла (aMg = 1) равновесная с паром магния активность кислорода в стали составляет менее 10–8. В результате этого у поверхности пузыря возникают условия для образования сульфидов магния даже при очень малой активности серы в металле.
Таким образом, при протекании реакции между магнием и кислородом в диффузионной области у поверхности всплывающих в металле пузырей пара реагентов должны существовать условия для одновременного протекания реакций раскисления и десульфурации независимо от окисленности металла в основном его объеме. Но возможность образования сульфидов у поверхности всплывающих в чугуне пузырей пара магния еще не гарантирует десульфурацию металла. Если образовавшиеся сульфиды не выносятся всплывающими пузырями из металла в шлак или газовую фазу, в расплаве возможно взаимодействие между сульфидами и растворенным в чугуне кислородом. Эта реакция сопровождается образованием термодинамически более устойчивых оксидов магния и обратным переходом серы в обрабатываемый металл. Поэтому десульфурацию металла магнием следует рассматривать как процесс, эффективность которого определяется интенсивностью двух одновременно протекающих реакций – образованием сульфидов у поверхности всплывающих в расплаве пузырей пара десульфуратора и частичным их окислением в результате взаимодействия с растворенным в металле кислородом, оксидами железа шлака и кислородом атмосферы.
Необходимо выяснить, согласуются ли высказанные выше представления о механизме реакций с результатами экспериментов. Для этого нужно получить кинетические уравнения, которые описывают динамику совместного изменения содержания серы и кислорода в металле, и сопоставить характер теоретических и экспериментальных зависимостей. Выполним такое сравнение на примере десульфурации магнием значительно более окисленных расплавов сталеплавильного производства.
Если лимитирующим звеном реакций между магнием и примесями стали является массоотдача кислорода и серы из объема металла, скорости реакций у поверхности пузырей десульфуратора могут быть описаны уравнениями:

Если предположить, что суммарная площадь поверхности пузырей пара магния в расплаве остается неизменной, а равновесные с паром магния концентрации кислорода и серы пренебрежимо малы по сравнению с концентрациями этих элементов в объеме металла, уравнения (3.11) и (3.12) можно привести к виду

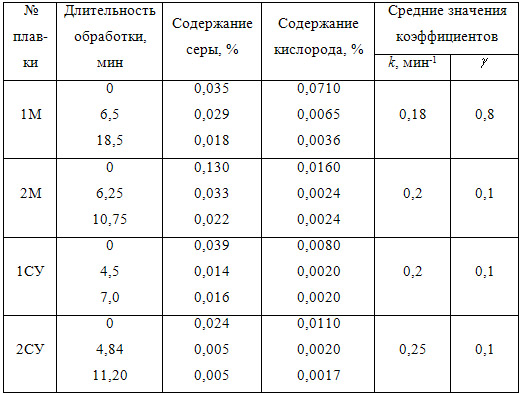
В таблице 3.3 приведены данные о изменении содержания серы и кислорода в металле при обработке магнием низкоуглеродистой и среднеуглеродистой стали. В этой же таблице показаны значения коэффициентов (М) и (СУ), полученные путем обработки результатов экспериментальных исследований в соответствии с уравнениями (3.17) и (3.18).
Таблица 3.3 – Изменение содержания серы и кислорода при обработке магнием мало- (М) и среднеуглеродистой (СУ) стали
На рисунке 3.4 результаты расчетов по уравнениям (3.17) и (3.18) сопоставлены с экспериментальными данными. Из рисунка видно, что результаты эксперимента не противоречат высказанным выше представлениям о механизме протекающих реакций.
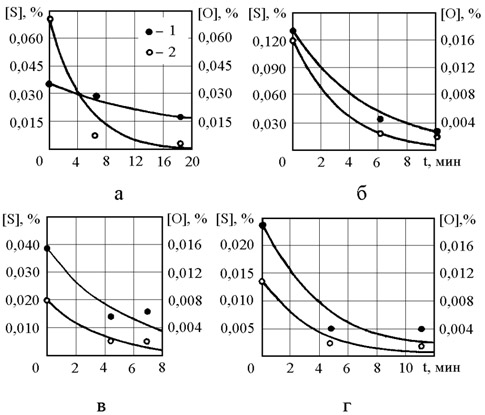
Рисунок 3.4 – Изменение содержания кислорода и серы в стали при обработке магнием: а – 1М; б – 2М; в – 1СУ; г – 2СУ; 1 – сера; 2 – кислород
