Коррозия и коррозионностойкие материалы
Коррозией (лат. corrodere – разъедать, разрушать) называют разрушение материалов под влиянием окружающей среды в результате ее химического или электрохимического воздействия.
Обычно рассматривают коррозию металлических материалов. Однако это явление характерно не только для металлов и сплавов, аналогичные процессы могут происходить и в неметаллических материалах – пластмассах, керамике. Примером такого коррозионного воздействия может служить износ футеровки плавильных печей под действием жидкого, химически активного шлака.
Ущерб, причиняемый коррозией, может быть прямым и косвенным. Прямой ущерб включает стоимость замены подвергшихся коррозии частей машин, трубопроводов, устройств. Для восстановления пораженных коррозией оборудования и конструкций ежегодно расходуется не менее 10 % продукции мирового металлургического производства.
Косвенный ущерб от коррозии связан с простоем оборудования в результате аварий, ухудшением качества продукции, например в результате ее загрязнения, увеличением расхода топлива, материалов, энергии. Так, при выходе из строя химической аппаратуры не выпускается продукция, отказ в работе двигателей приводит к простою ценного оборудования, нарушение герметичности газо- и нефтепроводов делает возможной утечку ценного сырья. Если в результате коррозии водопроводной системы прекращается подача воды на металлургический завод, то ремонт водопровода будет стоить во много раз меньше, чем расходы, связанные с остановкой завода на несколько часов. В зависимости от страны и климатических условий суммарный ущерб, наносимый коррозией, достигает уровня 3 – 10% валового продукта.
Проникновение в результате коррозии газа, нефти и других продуктов в окружающую среду приводит не только к материальным потерям, но и к угрозе жизнеобеспечению человека и природы. Если ущерб от замены и ремонта оборудования можно хотя бы рассчитать, то ущерб окружающей среде не поддается расчету.
В зависимости от свойств окружающей среды и характера ее физико-химического воздействия на материал различают:
1) химическую коррозию, обусловленную воздействием сухих газов, а также жидкостей, не являющихся электролитами (нефть, бензин, фенол);
2) электрохимическую коррозию, обусловленную воздействием жидких электролитов: водных растворов солей, кислот, щелочей, влажного воздуха, грунтовых вод, т. е. растворов, содержащих ионы и являющихся проводниками электричества.
Наиболее распространенным видом химической коррозии является газовая коррозия при высоких температурах – процесс взаимодействия с кислородом или активными газовыми средами (галогены, диоксид серы, сероводород, пары серы, диоксид углерода и т. д.). При газовой коррозии разрушаются такие ответственные узлы и детали, как лопатки газовых турбин, сопла реактивных двигателей, арматура печей.
В производственных условиях чаще всего сталкиваются с окислением металлов, в случае сплавов на основе железа – с образованием окалины. Защитные свойства металлов от окисления обусловлены образованием сплошных оксидных пленок на их поверхности. Для обеспечения сплошности пленок необходимо, чтобы объем оксида Vок был больше объема металла Vмет, из которого он образовался: Vок/Vмет > 1. В противном случае получается прерывистая пленка, не способная эффективно защитить металл от коррозии. Такая пленка характерна для магния (Vок/Vмет = 0,79), что затрудняет защиту сплавов на его основе от коррозии.
Помимо сплошности оксидные пленки должны обладать высокими механическими свойствами, иметь хорошее сцепление с металлом и достаточную толщину, обеспечивающую высокие защитные характеристики. Этим требованиям удовлетворяет пленка оксида хрома Сr2О3, что обусловливает высокую устойчивость против коррозии сталей и жаростойких сплавов с высоким содержанием хрома.
Электрохимическая коррозия – наиболее распространенный вид коррозии металлов. При электрическом контакте двух металлов или двух различающихся по свойствам фазовых составляющих одного металла, которые обладают разными электродными (электрохимическими) потенциалами, но находятся в одном электролите, образуется гальванический элемент. Поведение металлов или отдельных фаз зависит от значения их электродного потенциала. Металл или фаза, имеющие более отрицательный электродный потенциал (анод), отдают положительно заряженные ионы в раствор и растворяются (рисунок 6.1). Избыточные электроны перетекают в металл или фазу, имеющие более высокий электродный потенциал (катод). Катод при этом не разрушается, а электроны из него удаляются во внешнюю среду. Чем ниже электродный потенциал металла или фазы по отношению к стандартному водородному потенциалу, принятому за нулевой уровень, тем легче металл или фаза отдают ионы в раствор, тем ниже их коррозионная стойкость.
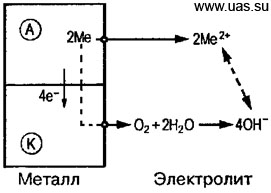
Рисунок 6.1 – Схема электрохимического коррозионного процесса
Значения электродного потенциала Ео некоторых металлов приведены ниже:
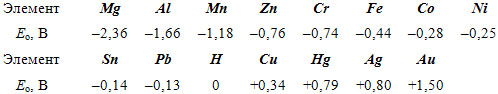
Ход электрохимического процесса определяется разностью потенциалов элементов, который, например, для пары Сu – Zn разность потенциалов составляет 1,1В.
В случае замкнутой цепи медь является катодом, а цинк – анодом, что приводит к его растворению. Если приложить напряжение более 1,1 В, то анод и катод поменяются местами, что приведет к растворению меди и восстановлению металлического цинка.
В зависимости от коррозионной среды различают два вида электрохимической коррозии – с водородной и кислородной деполяризацией.
Коррозия с водородной деполяризацией характерна для разрушения металлов в кислотной среде. Примером может служить та же пара Cu – Zn, находящаяся в растворе H2SO4 (рисунок 6.2).
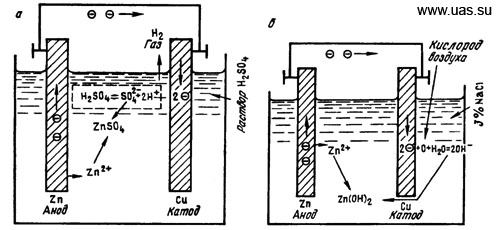
Рисунок 6.2 – Схемы процессов, протекающих в гальваническом элементе: а – водородная деполяризация; б – кислородная деполяризация
Благодаря отрицательному потенциалу цинк разрушается и в раствор переходят положительные ионы цинка.
Вследствие полярного строения молекул воды происходит гидратация ионов
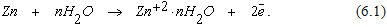
Освобождающиеся электроны движутся по внешней цепи от анода к катоду
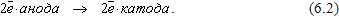
Вблизи катода имеются положительные ионы водорода Н+, образовавшиеся в результате диссоциации серной кислоты
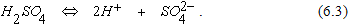
Ионы водорода, соединяясь с подошедшими к катоду электронами, образуют молекулы водорода, пузырьками выделяющегося с поверхности катода

Ионы водорода выступают в роли деполяризаторов. Они отводят электроны с катода и способствуют восстановлению его потенциала.
Продуктом коррозии является сульфат цинка, образовавшийся в результате соединения ионов SO42- с перешедшими в раствор ионами Zn2+
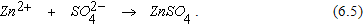
При кислородной деполяризации электроны отводятся кислородом, растворенным в электролите и попадающим туда из воздуха. Примером может служить коррозия цинка в контакте с медью в водном растворе какой-либо соли, например NaCl, водимой для увеличения электропроводности среды.
Электроны отводятся с катода путем взаимодействия с кислородом и водой по схеме
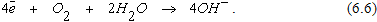
Возможна схема с образованием пероксида водорода
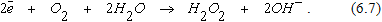
В обоих случаях деполяризатором является кислород. От подвода кислорода к аноду зависит скорость всего коррозионного процесса.
Образующиеся гидроксильные ионы, соединяясь с ионами цинка, образуют Zn(OH)2
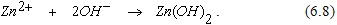
Анализ работы гальванических элементов позволяет заключить, что при коррозии всегда разрушается анод из металла с меньшим электродным потенциалом. Катод не разрушается и является электродом, на котором осуществляются процессы деполяризации.
