Кристаллизация металлических расплавов
Основы термодинамической теории кристаллизации
В силу того, что внутренняя энергия разупорядоченной жидкости выше, чем упорядоченного твердого тела, при фазовом превращении жидкости в твердое кристаллическое состояние выделяется теплота. Температура кристаллизации определяется как температура, при которой энергии Гиббса твердой и жидкой фаз равны.
Если измерять температуру чистого металла в процессе медленного охлаждения и затвердевания (создав, таким образом, условия близкие к равновесным), то получается кривая, подобная кривой охлаждения, изображенной на рис. 2.1. Наиболее интересной особенностью этой кривой является ее горизонтальный участок, соответствующий температуре кристаллизации и доказывающий, что кристаллизация чистого металла протекает при постоянной температуре, характерной для данного металла. При этом теплоты затвердевания, выделяющейся во время кристаллизации, достаточно для поддержания металла в жидком состоянии в этот период.
Принято считать, что кристаллизация металлов происходит в результате образования кристаллических зародышей, вырастающих затем в зерна или кристаллы путем присоединения атомов. Зародышеобразование начинается тогда, когда кинетическая энергия атомов жидкого метал ла достигает достаточно низкого уровня, что позволяет им занять узлы кристаллической решетки, свойственной данному металлу. Рост зародышей развивается по мере отвода теплоты от металла.
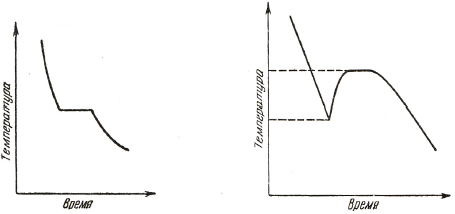
Рисунок 2.1 - Кривая термического охлаждения чистого металла
Образование поверхности раздела между твердой и жидкой фазами требует затраты энергии. Флуктуации, возникающие в результате уплотнения некоторых количеств атомов при температуре кристаллизации и выше ее, неустойчивы. Ниже температуры кристаллизации часть этих флуктуаций приобретает устойчивость, что должно привести к появлению зародышей твердой фазы в гомогенной жидкой среде. Это явление получило название гомогенной кристаллизации.
Зародыш сохранит устойчивость и сможет расти только в том случае, если суммарная энергия Гиббса системы 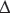 G, слагающаяся из поверхностной и объемной энергий будет уменьшаться. Существует критическое значение радиуса зародыша r*:
G, слагающаяся из поверхностной и объемной энергий будет уменьшаться. Существует критическое значение радиуса зародыша r*:

При переохлаждении расплава, равном нулю, радиус критического зародыша становится бесконечным. Это означает, что при температуре кристаллизации зародыш твердой фазы не может возникнуть. При увеличении переохлаждения критический размер зародыша уменьшается. Если образуется зародыш с радиусом большим чем r*, то дальнейшее увеличение его размеров сопровождается уменьшением 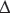 G, и такой процесс будет развиваться самопроизвольно. Образование зародыша с радиусом, меньшим, чем r*, сопровождается увеличением энергии Гиббса, и зародыш такого размера имеет тенденцию к исчезновению.
G, и такой процесс будет развиваться самопроизвольно. Образование зародыша с радиусом, меньшим, чем r*, сопровождается увеличением энергии Гиббса, и зародыш такого размера имеет тенденцию к исчезновению.
Результаты оценочных расчетов показывают, что в зародыше критического размера при гомогенном его образовании должно заключаться примерно 200-220 атомов. При этом величина переохлаждения, необходимая для начала гомогенного зарождения кристалликов из металлических расплавов, оказывается весьма значительной - 0,2 Тпл. Известно, что такие величины переохлаждения металла никогда не наблюдаются на практике. В реальных условиях при кристаллизации больших масс металла величина переохлаждения колеблется в пределах 1-10 К. Это свидетельствует о том, что в реальных условиях развитие гомогенного механизма зародышеобразования при кристаллизации представляется маловероятным.
В промышленных условиях при затвердевании слитков и отливок происходит гетерогенное зарождение кристаллов, то есть, кристаллы образуются на поверхности твердых частиц, находящихся в металлическом расплаве. В качестве готовых поверхностей раздела, пригодных для образования кристаллов металла, могут служить стенки изложницы, нерастворимые примеси, неметаллические включения и другие твердые поверхности, которые принято называть подложкой.
В данном случае условия гетерогенного зарождения кристаллов в значительной степени определяются величиной краевого угла смачивания 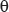 , которая зависит от таких факторов, как близость структур кристаллических решеток подложки и твердой фазы, химическая природа подложки, топография поверхности подложки, наличие адсорбционных слоев на поверхности подложки и т.п.
, которая зависит от таких факторов, как близость структур кристаллических решеток подложки и твердой фазы, химическая природа подложки, топография поверхности подложки, наличие адсорбционных слоев на поверхности подложки и т.п.
Если краевой угол смачивания между подложкой и образующимся на ней зародышем твердой фазы 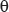 мал, то межфазная поверхностная энергия на границе раздела зародыш–подложка также мала и на поверхности подложки легко образуются зародыши из атомов жидкого металла. Если краевой угол
мал, то межфазная поверхностная энергия на границе раздела зародыш–подложка также мала и на поверхности подложки легко образуются зародыши из атомов жидкого металла. Если краевой угол 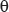 = 180о, то подложка не оказывает заметного влияния на процессы зарождения.
= 180о, то подложка не оказывает заметного влияния на процессы зарождения.
В случае, если образование устойчивого зародыша твердой фазы на подложке происходит с участием одного и того же числа атомов (r*=const), то уменьшение краевого угла 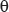 приводит к значительному снижению переохлаждения.
приводит к значительному снижению переохлаждения.
Как было указано выше, к зародышам гетерогенной кристаллизации следует отнести включения различной структуры, например, оксиды, сульфиды, нитриды, силикаты и др. Чем больше структурное сходство их кристаллической решетки с решеткой затвердевшего металла, тем меньше угол смачивания 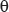 и тем скорее эти включения станут активными зародышами кристаллизации.
и тем скорее эти включения станут активными зародышами кристаллизации.
К зародышам вынужденной кристаллизации принято относить и обломки дендритов, возникающие вследствие разрушения твердого каркаса под воздействием различного рода внешних воздействий (перемешивание расплава, упругие волны и пр.).
Таким образом, процесс гетерогенного зародышеобразования при кристаллизации металлического расплава зависит, прежде всего, от степени загрязнения металла неметаллическими включениями, от интенсивности и направления движения расплава в жидкой фазе в процессе затвердевания, наличия внешних динамических воздействий (вибрация, встряхивание и пр).
Между тем, даже в случае присутствия в расплаве чужеродных тел, способных инициировать образование зародышей, всегда необходимо определенное переохлаждение (активация) расплава. При этом более мелкозернистую конечную структуру слитка можно также получить следующими методами:
- искусственным увеличением числа зародышей (модифицированием);
- устранением включений и кластеров, которые вызывают кристаллизацию при малом переохлаждении.
В отличие от чистых металлов при кристаллизации многокомпонентных расплавов, к которым относятся промышленные марки стали, возникает так называемое концентрационное (диффузионное) переохлаждение. Возникновение последнего связано с ликвацией компонентов расплава. Ликвацией в данном случае называют различие химического состава твердой и жидкой фаз, возникающее при кристаллизации. Если жидкость обогащается примесным элементом, ликвацию считают положительной, а если обедняется – отрицательной. Различия в химическом составе в результате ликвации сохраняются в стали после завершения затвердевания.
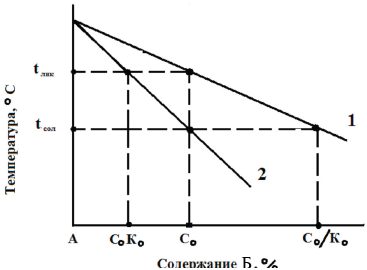
Рисунок 2.2 – Участок диаграммы состояния бинарного сплава для К0 < 1
Например, для простого бинарного сплава из компонентов А и Б, имеющего фазовую диаграмму, подобную представленной на рис.2.2, коэффициент распределения Ко представляет собой отношение концентрации растворенного вещества в твердой фазе Ст к концентрации растворенного вещества в жидкости Сж, с которой твердая фаза сосуществует в равновесии.
При охлаждении жидкости концентрация растворенного вещества в которой равна Со, до температуры ликвидуса Тl первые выделения твердой фазы имеют концентрацию растворенного вещества Со Ко. Поскольку содержание растворенного вещества в твердой фазе меньше, чем в основной массе жидкости, избыток растворенного вещества, равный Со(1 - Ко), накапливается у продвигающегося фронта кристаллизации. Соответственно, если времени для жидкофазной диффузии накапливающегося растворенного вещества недостаточно, то концентрация растворенного вещества в жидкости, примыкающей к межфазной поверхности жидкость - твердая фаза, будет существенно выше, чем в основной массе жидкости.
Согласно теории Б.Чалмерса, в данном случае наблюдается концентрационное переохлаждение, которое при удалении от границы кристаллов вначале увеличивается до максимума, а затем снижается до нуля. Следовательно, у однородного сплава в результате описанного явления в направлении повышающейся температуры появляется переохлажденный слой, который оказывает влияние на форму фронта кристаллизации, а значит, и на конечную первичную структуру кристаллизующегося сплава. По мере накопления растворенного вещества у фронта кристаллизации переохлаждение жидкости у межфазной поверхности все более снижается.
При этом рост границы раздела фаз замедляется окончательно. Между тем, в силу целого ряда факторов одно родное распределение накапливающихся растворенных веществ не в состоянии сохраняться на продвигающейся поверхности раздела фаз и некоторые локальные участки межфазной границы жидкой и твердой фаз, обладающие наименьшей концентрацией растворенного вещества, оказываются в условиях преимущественного роста. Так, если на локальном участке A продвигающейся поверхности раздела фаз накопилось больше растворенного вещества, чем на участке В, то локальный участок В межфазной поверхности растет быстрее и образует некоторый выступ. При этом переохлаждение на участке А уменьшается в большей степени, а рост кристаллов на участке В продолжается. Таким образом, термическое переохлаждение расплава в процессе затвердевания снижается в результате ликвации растворенного вещества в жидкости, примыкающей к поверхности раздела жидкой и твердой фаз, а преимущественный рост получают участки межфазной поверхности с наименьшей депрессией переохлаждения. При этом условие равновесия при кристаллизации никогда не соблюдается в действительности и всегда существует переохлаждение жидкости у продвигающейся поверхности раздела жидкой и твердой фаз, обеспечивающее рост кристаллов.
Из вышеизложенного следует важность определения температуры начала и конца затвердевания сплавов (ликвидуса и солидуса в условиях, близких к равновесным).
Определение температуры-ликвидус стали Tl обычно осуществляется по эмпирическим формулам в виде полиномных выражений с использованием данных о химическом составе стали:
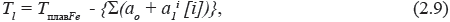
где TплавFe – температура плавления чистого железа (в соответствии с большей частью рекомендаций TплавFe = 1539оС);
ao– коэффициент приведения температуры плавления чистого железа (вводится в случае принятия значения температуры плавления железа, отличного от приведенного выше);
ai – коэффициент значимости для соответствующего i-го элемента, содержащегося в стали данной марки;
[i] – содержание i-го элемента в данной марке стали в процентах.
В качестве основы выражений такого типа принята гипотеза о том, что каждый из химических элементов влияет на снижение температуры ликвидус и железа независимо один от другого. Поэтому данные выражения различаются только тем, каким образом аппроксимируется линия ликвидуса в бинарной диаграмме (табл.2.2).
Таблица 2.2 - Коэффициенты а0 и а1i, характеризующие степень влияния содержащихся в стали химических элементов на снижение температуры ликвидус
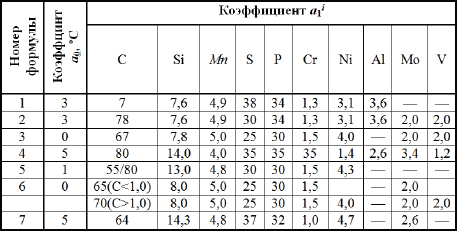
Вместе с тем, расчет температур ликвидуса для различных марок стали невозможно провести с помощью только одной «универсальной» формулы. В соответствии с выполненными статистическими исследованиями, проведенными авторами на основании практических данных, рекомендации по использованию этих формул даны в табл.2.3.
Таблица 2.3 - Рекомендуемые формулы для расчета температуры ликвидус в зависимости от химического состава стали

Расчет равновесной температуры солидус для многокомпонентных расплавов не имеет практического значения, т.к. температура конца затвердевания зависит от скорости охлаждения и степени ликвации примесей.
В реальных случаях концентрация ликвирующих примесей в локальных объемах незатвердевшей жидкости больше чем следует из равновесной диаграммы состояния, а температура конца затвердевания существенно ниже равновесной. Поэтому температуру конца затвердевания целесообразно определять экспериментальными методами, например, термическим анализом.
