Моделирование раскисления стали монолитным углеродом
Р.В. Синяков, Е.Л. Корзун
УДК 669.18.046.558.2:550.34.013.4
Введение и состояние вопроса
Раскисление металла является одним из основных мероприятий определяющих качество стали. Сам процесс удаления кислорода ограничен кинетическими и термодинамическими факторами, что обуславливает выбор средств для проведения этой процедуры. В конце прошлого столетия Сапиро В.С. с сотрудниками предложили метод рафинирующей обработки жидкого металла, основанный на взаимодействии твёрдого углерода в монолитном виде с растворенным в металле кислородом [1,2]. Эксперименты, проведенные в промышленных условиях, показали эффективность предложенного способа - достигались концентрации кислорода в металле ниже равновесных с объёмной концентрацией углерода. При этом практически отсутствовало науглероживание металла, в отдельных случаях наблюдали снижение содержания углерода в расплаве.
В качестве гипотезы, авторы предположили, что эффект «выкачивания» кислорода из объёма расплава обусловлен локальным превышением концентрации углерода в реакционной зоне над концентрацией его в объёме ванны. На этой основе ими была разработана модель оценивающая величину отклонения концентрации кислорода от равновесной с углеродом вне реакционной зоны [2]. Согласно модели степень переокисления 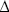 [O] может быть отрицательной величиной, предельное значение которой равно:
[O] может быть отрицательной величиной, предельное значение которой равно:

где [C]об - объёмная концентрация углерода в металле, %.
Как видно, предложенный подход носит чисто качественный характер, не позволяющий оценить количественно степень раскисления металла и, тем более, ответить на вопрос о причинах существенных отрицательных отклонений фактических концентраций кислорода от равновесных с углеродом значений, и отсутствии науглероживания металла.
Постановка задачи
Поэтому в данной работе была предпринята попытка разработки модели позволяющей количественно описать исследуемый процесс, что даст возможность получить ответы на поставленные вопросы.
Основные материалы исследования
В работах [1,2] авторы обработку стали в 10-тонном конвертере вели с использованием углеродистого блока, который погружали в ванну и выдерживали его с различной длительностью. Как отмечается, характерной особенностью процесса является наличие в расплаве двух областей: реакционной зоны, локализованной вблизи монолитного углерода, где наблюдается интенсивное выделение оксида углерода, и «остальной» ванны. Более того, исследованиями установлено, что в пределах реакционной зоны содержание углерода достигало 3-4 %, что намного выше, чем в объёме металла. Т.е. происходит диффузионное растворение углеродистого блока. Со временем этот процесс переходит в стационарный режим, поддерживая высокую концентрацию углерода в реакционной зоне.
В результате в реакционной зоне появляются термодинамические условия к образованию оксида углерода отличные от таковых в объёме металла: наличие кислорода и высокое содержание углерода. За счёт раскисления металла в реакционной зоне существуют два противоположно направленных потока: с одной стороны поток углерода, постоянно поддерживаемый монолитным блоком, с другой стороны поток кислорода, подпитываемый новыми порциями металла за счёт перемешивания ванны пузырями СО.
Важным условием, определяющим успешность представленного механизма, является необходимость быстрого удаления образующихся продуктов реакции из зоны взаимодействия [3]. В противном случае образующийся оксид углерода, покидая реакционную зону, будет растворяться в объеме металла. Согласно данным [2] этого не происходит, что подтверждается интенсивным кипением ванны вблизи монолитного углерода.
Для имитации процессов происходящих в реакционной зоне разработали схему, аналогичную [3,4], в качестве остова которой приняли термодинамическую модель [5,6]. Кинетику растворения углерода представили в виде смены «реакционных» зон, в которых принимается равновесное состояние системы [7], с учётом диффузионной подвижности рассматриваемых элементов. Для этого ввели безразмерный параметр, отражающий относительную диффузионную подвижность кислорода, как отношение коэффициентов диффузии кислорода и углерода. По данным [8], коэффициент диффузии углерода в жидком железе при 1600оС равен 7,2x10-9 м2/с, а коэффициент диффузии кислорода, согласно обширному обзору, выполненному в [9], равен 1,4x10-8 м2/с. Таким образом, относительная диффузионная подвижность кислорода будет равна 2.
На рис. 1 представлены результаты моделирования обработки металлического расплава монолитным углеродом согласно механизму, представленному выше. Как видно (рис. 1 (а)), в процессе обработки возможно получение концентраций кислорода ниже равновесных с объёмной концентрацией углерода.
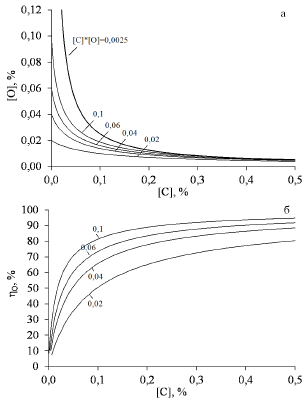
Рисунок 1 – Моделирование содержания кислорода (а) и степень раскисления металла (б) в металле в зависимости от конечного содержания углерода. Относительная диффузионная подвижность кислорода - 2. Цифры у кривых – исходное содержание кислорода в металле, %
Кривые содержания кислорода в металле в зависимости от концентрации углерода для разных исходных значений кислорода лежат ниже равновесной кривой, описываемой выражением [C]x[O] = 0,0025. Удаление кислорода происходит практически при любом исходном его содержании в металле.
Авторы [2] отмечали факт различного поведения системы при концентрациях углерода ниже и выше 0,20%. При высоких концентрациях углерода эффект отрицательного переокисления проявляется меньше, что согласуется с расчётом – при концентрации углерода в металле выше 0,25-0,3% кривые содержания кислорода в металле почти сливаются с равновесной кривой. Степень раскисления металла при вводе углерода до концентраций, соответствующих сотым долям процента, равна 50% (рис. 1 (б)), что объясняет практическое отсутствие науглероживания металла при низких содержаниях углерода. Основная масса вводимого углерода 80-95% расходуется на раскисление металла (рис. 2).
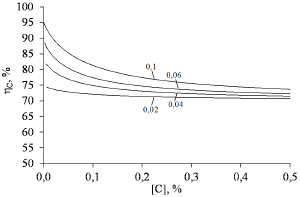
Рисунок 2 – Расчётный расход углерода на раскисление в зависимости от его конечного содержания в стали. Цифры у кривых – исходное содержание кислорода в «активной» зоне, %.
С увеличением исходного содержания кислорода в металле и уменьшением расхода углерода степень использования углерода на раскисление металла растёт (рис. 3).
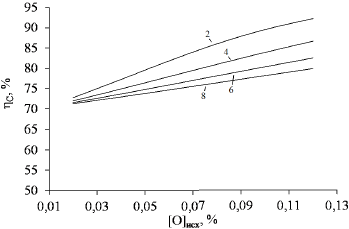
Рисунок 3 – Расчётная степень использования углерода на раскисление в зависимости от исходного содержания кислорода. Цифры у кривых – расход углерода, кг/тонну.
На рис. 4 представлены результаты промышленных плавок по обработке нераскисленного металла углеродистым блоком в 10-т конвертере [1,2].
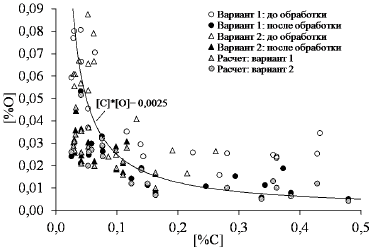
Рисунок 4 – Соотношения концентраций углерода и кислорода в стали до и после обработки монолитным углеродом в конвертере при разной длительности обработки в сравнении с расчётными значениями. Вариант 1 – длительность обработки 3-6 мин, вариант 2 – 1,5 – 2,5 мин.
Приведённые на этом рисунке результаты моделирования показали хорошую сходимость с промышленными данными, что подтверждает адекватность рассматриваемого механизма и разработанной на его основе модели.
Выводы
Таким образом, моделированием обработки нераскисленного металла монолитным углеродом показано, что, ранее разработанная на основе принципа квазилокального равновесия, модель [3,4] адекватно отражает некоторые особенности поведения элементов в металле при их диффузионном растворении. Моделированием показано, что в процессе обработки металла монолитным углеродом возможно получение концентраций кислорода ниже равновесных с углеродом значений. Это явление не связано с нарушением термодинамических основ, а является отражением локальности протекающих процессов и наличием факторов способствующих их эффективности: высокое содержание элементов в реакционной зоне; постоянный градиент концентраций кислорода и углерода, обеспечивающий непрерывный поток; быстрое удаление продуктов реакции из системы.
Отсутствие науглероживания металла при концентрациях углерода до 0,25% объясняется тем, что основная масса последнего 80-95% расходуется на раскисление металла.
СПИСОК ЛИТЕРАТУРЫ
- Терещенко В.Т. Механизм раскисления стали монолитным углеродом / В.Т. Терещенко, В.С. Сапиро, Н.П. Семенов // Известия вузов. Черная металлургия. – 1975, № 1. – С.31–34.
- Сапиро В.С. Причины отрицательных отклонений фактических концентраций кислорода от равновесных при окислении углерода в сталеплавильной ванне / В.С. Сапиро, Н.П. Семенов // Известия вузов. Черная металлургия. – 1989, № 3. – С.43–46.
- Наконечный А.Я. Оценка десульфурации железа марганцем / А.Я. Наконечный, В.Н. Урцев, Р.В. Синяков [и др.] // Сталь. – 2010, № 5. – С.69–73.
- Наконечный А.Я. Марганец как десульфуратор металла / А.Я. Наконечный, Р.В. Синяков // Труды конференции "Инновационные технологии внепечной металлургии чугуна и стали". – Донецьк, ДонНТУ, 2011. – С.137-142.
- Харченко А.В. Экспериментальные основания термодинамической модели коллективизированных электронов / А.В. Харченко, А.Г. Пономаренко // Наукові праці ДонНТУ Вип.66. Серія "Металургія". – Донецьк, ДонНТУ, 2003. – С.17-24.
- Харченко А.В. Термодинамическое моделирования системы «металл-шлак-газ» с учетом энтальпийного теплового баланса //Металл и литье Украниы. – 2005, № 6. – С.13-17.
- Пономаренко А.Г. Термодинамика и кинетика в современных системах управления металлургической плавкой / А.Г. Пономаренко, Р.В. Синяков, С.В. Довгонюк, Е.Л. Корзун // Вестник ЮУрГУ. – Челябинск: Изд-во ЮУрГУ, 2002. – № 2 – С.32–35.
- Григорян В.А. Теоретические основы электросталеплавильных процессов / В.А. Григорян, Л.Н. Белянчиков, А.Я. Стомахин – М.: Металлургия, 1987. – 272с. 9. Линчевский Б.В. Термодинамика и кинетика взаимодействия газов с жидкими металлами. – М.: Металлургия, 1986. – 222с.
Надійшла до редакції 26.10.2011
Рецензент д.т.н., проф. О.А. Троянський
© Р.В. Синяков, Е.Л. Корзун
